ENLACE QUÍMICO SECUNDARIA BACHILLERATO
ENLACE QUÍMICO PARA SECUNDARIA Y BACHILLERATO:
Un enlace químico es la interacción física responsable de las relaciones entre átomos, moléculas e iones, que supone una mayor estabilidad en los compuestos diatómicos y poliatómico. Son las fuerzas que mantienen unidos a los átomos en las sustancias.
Los átomos se unen para formar agrupaciones estables. Los átomos se unen para formar agrupaciones estables. Los responsables de los enlaces son los electrones de valencia (los de nivel más externos, los de mayor energía).
En general, el enlace químico fuerte está asociado a la transferencia de electrones de valencia entre los átomos participantes. Las moléculas, cristales, y gases diatómicos está unido por enlaces químicos, que determinan las propiedades físicas y químicas de la materia.
ASPECTOS FORMALES:
SABERES BÁSICOS PREDOMINANTES IMPLICADOS EN LO QUE RESPECTA A FÍSICA Y QUÍMICA DE SECUNDARIA:
Las cargas opuestas se atraen, porque, al estar unidas, adquieren una situación más estable que cuando estaban separados.
Esta situación de mayor estabilidad suele darse cuando el número de electrones que poseen los átomos en su último nivel es igual a ocho, estructura que coincide con la de los gases nobles, que más que «nobles» deberían llamarse «influencers», ya que todos los átomos desean parecerse a ellos, tener la misma configuración electrónica que ellos.
Bueno… eso es con respecto a esta cuestión… pero teniendo en cuenta que no se unen con nadie, deberían llamarse «solitarios».
Lo anterior es la REGLA DEL OCTETO:
“Todos los átomos tienden a rodearse de 8 electrones (alcanzando la configuración de gas noble) en su nivel más externo”.
CONFIGURACIÓN ELECTRÓNICA:
Brevemente: Los electrones en la corteza del átomo, no se sitúan arbitrariamente y todos juntos, sino que lo hacen en niveles (como pisos de un edificio) y en orbitales determinados (con su forma y número de electrones que caben en ellos).
Los pisos, niveles, se indican con un número creciente; los orbitales con letras (s, p, d, f).
En los orbitales s pueden entrar dos electrones, en los p 6 electrones, en los d diez electrones y en los f 14 electrones.
Como consecuencia de varios condicionantes (el valor de la energía en cada nivel y orbital), el llenado de esos orbitales se realiza con la regla que describe el DIAGRAMA DE MOELLER:
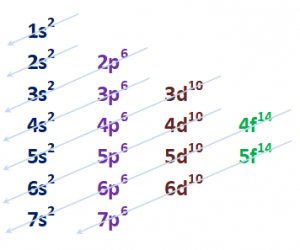
¿podrían intentar ver una relación de esos números con algo de la tabla periódica?
Veamos el magnesio y el azufre:
Mg (Z = 12): 1s2 2s2 2p6 3s2 ; Tiende a perder esos dos electrones externos (formará ión positivo)
S (Z = 16): 1s2 2s2 2p6 3s2 3p4 ; Tiende a ganar esos 2 electrones, si le damos la oportunidad (formará ión positivo)
Los electrones que orbitan el núcleo están cargados negativamente, y los protones en el núcleo lo están positivamente. La configuración más estable del núcleo y los electrones es una en la que los electrones pasan la mayor parte del tiempo entre los núcleos, que en otro lugar del espacio. Estos electrones hacen que los núcleos se atraigan mutuamente.
ENLACE IÓNICO:
Consiste en la atracción electrostática que aparece entre los iones positivo y negativo que constituyen el compuesto iónico.
CARACTERÍSTICAS DE LOS ENLACES IÓNICOS:
- Forman compuestos iónicos. Ejemplos: Sales (NaCl, CaF2, Na2CO3,…)
- Se producen entre átomos de muy distinta electronegatividad
- Se produce una transferencia de electrones
- La fuerza que los mantiene unidos es la Fuerza electrostática (Ley de Coulomb)
EJEMPLOS:
Un átomo que cede uno o más electrones se transforma en un ión cargado positivamente o catión. Ejemplos de cationes son el catión sodio Na+1, el catión calcio Ca+2 y el catión aluminio Al+3. La capacidad de ceder electrones es característica de los metales.
Cuando un átomo acepta uno o más electrones se transforma en un ión cargado negativamente o anión. Ejemplos de aniones son el anión cloro o cloruro Cl-1, el anión azufre o sulfuro S-2 y el anión fosfato PO4-3.
Cuando iones con cargas opuestas entran en contacto, se produce una atracción electrostática y se forma el enlace iónico.
Por ejemplo, el catión sodio Na+1 forma un enlace iónico con el anión cloruro Cl-1 y forman el cloruro de sodio NaCl.
Na (11): 1s2 2s2 2p6 3s1
Cl (17): 1s2 2s2 2p6 3s2 3p5
Na+ + Cl– → NaCl
Por ejemplo, el catión calcio Ca 2+ forma un enlace iónico con dos aniones fluoruro F – y forman el fluoruro de calcio CaF2.
Ca (20): 1s2 2s2 2p6 3s2 3p6 4s2
F (9) : 1s2 2s2 2p5
F (9) : 1s2 2s2 2p5
Ca 2+ + 2F– → CaF2
PROPIEDADES DE LAS SUSTANCIAS IÓNICAS
- Tienden a formar redes cristalinas quebradizas: a nivel atómico, un cristal iónico tiene una estructura regular tridimensional, formada por el catión y el anión que se intercalan.
- Son eléctricamente neutros en su estado sólido.
- Tienen puntos de ebullición y fusión altos: las fuerzas de atracción entre los iones son mayor por lo que se requiere más energía para separarlas
- Son sólidos a temperatura ambiente debido a los altos puntos de fusión.
- Cuando se disuelven en agua son buenos conductores de la electricidad, mientras que en estado sólido son malos conductores.
ENLACE COVALENTE:
Se forman cuando dos o más átomos de carácter no-metálico comparten electrones, de modo que cada uno adquiere la configuración de gas noble.
Esto hace que los átomos se comporten como una unidad, que llamamos molécula. Los átomos interactúan entre sí a través de los electrones más externos formando enlaces.
Los enlaces son las fuerzas que mantienen juntos a los átomos para formar moléculas y compuestos. A diferencia del enlace iónico en que hay transferencia de electrones entre dos átomos, en el enlace covalente los electrones son compartidos entre los átomos.
CARACTERÍSTICAS DE LOS ENLACES COVALENTES:
- Los electrones se comparten. La fuerza que mantienen unidos a estos átomos no es la electrostática
- Es más fuerte que el enlace iónico
- Las sustancias covalentes suelen tener bajos puntos de fusión y de ebullición
- Los enlaces covalentes se establecen entre elementos no metálicos. Por ejemplo, el hidrógeno H, el oxígeno O y el cloro Cl se encuentran naturalmente como moléculas diatómicas unidas por enlace covalente: H2, O2 y Cl2.
- Los enlaces covalentes incluyen enlaces simples, dobles o triples donde 2, 4 o 6 electrones se comparten, respectivamente. Por ejemplo, en el compuesto orgánico etano H3C-CH3, la unión entre carbono-carbono y carbono-hidrógeno es simple. En el eteno H2C=CH2 la unión entre los carbonos es doble, compartiendo cuatro electrones.
- Los enlaces covalentes crean moléculas que pueden ser separadas con menos energía que los compuestos iónicos.
- El enlace covalente es más fuerte entre dos átomos con igual electronegatividad.
PROPIEDADES DE LAS SUSTANCIAS COVALENTES:
- A temperatura ambiente y a la presión atmosférica normal, los compuestos covalentes se pueden presentar como sólidos, líquidos o gases.
- Los compuestos covalentes no muestran conductividad eléctrica cuando son disueltos en agua. Cuando se disuelven estos compuestos las moléculas se separan y permanecen independientes, a diferencia de los compuestos iónicos, que se descomponen en sus iones positivos y negativos.
- Los compuestos covalentes tienen puntos de fusión y ebullición menores que los compuestos iónicos. La fuerza de atracción entre las moléculas es menor que en el enlace iónico, por eso se requiere menos energía para separarlas. Por ejemplo, el punto de fusión del cloruro de sodio NaCl (compuesto iónico) es 801 ºC y el de ebullición es 1465 ºC; el punto de fusión del agua (compuesto covalente) es 0 ºC y el de ebullición es 100 ºC.
- Los compuestos covalentes tienden a ser más combustibles.
- Muchos compuestos covalentes no son fácilmente solubles en agua. Aquellos compuestos covalentes polares, como el etanol y la glucosa se disuelven bien hasta cierto grado. En cambio, aceites y gasolina no son solubles en agua.
EJEMPLOS:
- Cl2, HCl, F2, H2O, CH4, NH3
…
ENLACE METÁLICO:
Los enlaces metálicos son un tipo de unión química que se produce únicamente entre los átomos de un mismo elemento metálico, formándose estructuras moleculares sumamente compactas, sólidas y resistentes, dado que los núcleos de sus átomos se juntan a tal extremo, que comparten sus electrones de valencia.
En el caso de los enlaces metálicos, lo que ocurre con los electrones es que abandonan sus órbitas acostumbradas alrededor del núcleo atómico cuando éste se junta con otro, y permanecen alrededor ambos como una especie de nube. De esta manera las cargas positivas y negativas mantienen su atracción, sujetando firmemente al conjunto atómico y alcanzando márgenes importantes de dureza, compactación y durabilidad, que son típicas de los metales en barra.
PROPIEDADES DEL ENLACE METÁLICO:
- Dureza, solidez, maleabilidad y conductibilidad
- La buena conducción del calor y de la electricidad de los metales se debe a la disposición tan particular de los electrones en nube alrededor de los núcleos, permitiendo su movilidad a lo largo y ancho del conjunto.
- este tipo de enlace repele casi toda la energía lumínica que los impacta, es decir, brilla.
- Suelen ser sólidos a temperatura ambiente, a excepción del mercurio que es líquido
EJEMPLOS DE SUSTANCIAS METÁLICAS:
Los enlaces metálicos son frecuentes en el mundo de los metales, por lo que cualquier elemento metálico puro es perfecto ejemplo de ello. Es decir, cualquier veta pura de: plata (Ag), oro (Au), cadmio (Cd), hierro (Fe), níquel (Ni), zinc (Zn), cobre (Cu), platino (Pt), aluminio (Al), galio (Ga), titanio (Ti), paladio (Pd), plomo (Pb), iridio (Ir) o cobalto (Co), siempre que no se encuentre mezclado con otros metales y elementos, se mantendrá unida mediante enlaces metálicos.
FUERZAS INTERMOLECULARES:
- Son las fuerzas de atracción existentes entre las moléculas de las sustancias covalentes
- No se trata de enlaces propiamente dichos
- Son los más débiles
- Pueden ser:
FUERZAS DE VAN DER WAALS (de naturaleza electrostática, débiles)
ENLACE DE HIDRÓGENO (entre el hidrógeno y átomos pequeños y muy electronegativos)
PUEDE INTERESAR IR A ENLACE QUÍMICO, EN LA FÍSICA Y EN LA VIDA
