FACTORES CONVERSIÓN REACCIONES QUÍMICAS
FACTORES DE CONVERSIÓN EN REACCIONES QUÍMICAS. ESTEQUIOMETRÍA:

PODRÍA INTERESAR LA CONSULTA DE LOS SIGUIENTES ARTÍCULOS RELACIONADOS:
- FACTORES DE CONVERSIÓN
- FACTORES DE CONVERSIÓN EN CAMBIOS DE UNIDADES DE FÍSICA Y QUÍMICA
- FACTORES DE CONVERSIÓN Y NOTACIÓN CIENTÍFICA. CAMBIOS DE UNIDADES EN FÍSICA Y QUÍMICA
- FACTORES DE CONVERSIÓN EN OBTENCIÓN DE CANTIDADES EN QUÍMICA
- RESOLUCIÓN DEL EJERCICIO FQ1BE1505 DE USO DE FACTORES DE CONVERSIÓN EN CÁLCULOS CON DISOLUCIONES
ESTE MATERIAL SIGUE LOS PROCESOS DETERMINADOS POR:
EJERCICIO FQ1BE3240:
Teniendo en cuenta la reacción de formación del amoniaco: ¿Cuánto amoniaco se obtiene con 15 gramos de hidrógeno?
DATOS: Mm(N)=14 u; Mm(H)=1 u
RESOLUCIÓN DEL EJERCICIO:
Partiendo de la reacción ajustada y del balance y moles que intervienen:
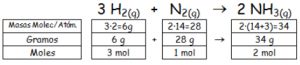
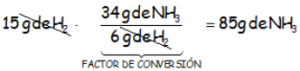
O trabajando con la relación de moles de la reacción, para captar mejor el funcionamiento de los factores:

SI FUERA NECESARIO EL PLANTEAMIENTO DE REACTIVO LIMITANTE Y EN EXCESO:
EJERCICIO FQ4EE1981:
Hallar la cantidad de vapor de agua que se produce cuando quemamos 5 gramos de propano en un ambiente cerrado en el que sólo hay 5 gramos de oxigeno gaseoso.
DATOS: Mm(C)=12 u; Mm(H)=1 u; Mm(O)=16 u
RESOLUCIÓN DEL EJERCICIO:
La fórmula semidesarrollada del propano es: CH3-CH2-CH3 que corresponde a una fórmula molecular C3H8.
Tener en cuenta que la combustión se produce en presencia de oxígeno obteniéndose anhídrido carbónico y agua. Con lo que la reacción de combustión del propano ajustada:
En este caso tenemos limitaciones de oxígeno, con lo que hay que estudiar las cantidades de propano y oxígeno que se ponen en juego en la reacción, ya que la proporción es tal que 1 mol de propano necesita 5 moles de oxígeno. Hay que estudiar lo que conocemos por REACTIVO LIMITANTE Y EN EXCESO.
La masa molecular del propano (C3H8) es 3·12 (C)+8·1 (H)=44 uma.
La masa molecular del oxígeno gaseoso (O2) es de 2·16(O)=32 uma.
Teniendo en cuenta lo anterior y que 1 mol de propano se combina con 5 moles de oxígeno, encadenando los factores de conversión correspondientes, vamos a obtener los gramos de oxígeno que necesitan los 5 gramos de propano:
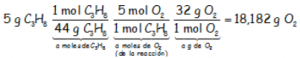
18,182 gramos de oxígeno son los que necesitan los 5 gramos de propano para que se produzca la combustión completa. No disponemos de 18 gramos de oxígeno con lo que el oxígeno es el limitante. No se va a quemar todo el propano, que está en exceso. La cantidad de propano que se va a quemar, de hecho es:
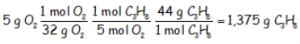
1,375 g de propano son los que se van a quemar con los 5 g de oxígeno de los que disponemos, quedando claro que el propano está en exceso.
Para los cálculos posteriores de la cantidad de vapor de agua que se produce, tendremos por lo tanto que utilizar los 5 gramos de oxígeno o los 1,375 g de propano que son los que intervienen en la reacción.
Utilizando el reactivo limitante, los 5 gramos de oxígeno, la cantidad de agua obtenida, teniendo en cuenta que la masa molecular del H2O es 18 uma = 16 (oxigeno) + 2·1 (hidrógeno) y que 5 moles de oxígeno producen 4 moles de agua, mediante factores de conversión:
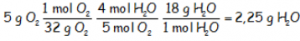
Utilizando el reactivo en exceso, el propano, del que tenemos que utilizar la cantidad de 1,375 g que es lo que realmente se quema, sabiendo que un mol de propano produce 4 moles de agua:
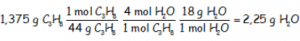
Que necesariamente tiene que darnos la misma cantidad.
