EJERCICIOS CANTIDAD QUÍMICA AVOGADRO
RESOLUCIÓN DE LOS EJERCICIOS FQ1BE2012 FQ1BE2013 DE CANTIDAD EN QUÍMICA Y LEY DE AVOGADRO:

 PODRÍA INTERESAR LA CONSULTA DE LOS SIGUIENTES ARTÍCULOS RELACIONADOS:
PODRÍA INTERESAR LA CONSULTA DE LOS SIGUIENTES ARTÍCULOS RELACIONADOS:
- FACTORES DE CONVERSIÓN
- FACTORES DE CONVERSIÓN EN CAMBIOS DE UNIDADES DE FÍSICA Y QUÍMICA
- FACTORES DE CONVERSIÓN Y NOTACIÓN CIENTÍFICA. CAMBIOS DE UNIDADES EN FÍSICA Y QUÍMICA
- FACTORES DE CONVERSIÓN EN OBTENCIÓN DE CANTIDADES EN QUÍMICA
- RESOLUCIÓN DEL EJERCICIO FQ1BE1505 DE USO DE FACTORES DE CONVERSIÓN EN CÁLCULOS CON DISOLUCIONES
- FACTORES DE CONVERSIÓN EN REACCIONES QUÍMICAS. ESTEQUIOMETRÍA
ESTE MATERIAL SIGUE LOS PROCESOS DETERMINADOS POR:
INTERESA RECORDAR LA LEY DE AVOGADRO:
- Que igual número de moléculas ocupan el mismo volumen siempre que las condiciones de presión y temperatura sean idénticas para todos los gases.
- Que en un mol de cualquier sustancia existe siempre el mismo número de moléculas.
EJERCICIO FQ1BE2012:
Disponemos de dos recipientes con el mismo volumen y en los que se dan idénticas condiciones de presión y temperatura. Si en el primero hay 2 gramos de oxígeno, y en el segundo hay una cantidad de hidrógeno indeterminada. ¿Cuántos gramos de hidrógeno hay en el segundo?.
DATOS: Ma(H) = 1 uma; Ma(O) = 16 uma.
Lo primero es tener claro que el oxígeno al que se refiere el ejercicio debe ser oxígeno gaseoso (O2) y el hidrógeno del segúndo, del mismo modo (H2).
Teniendo en cuenta que según Avogadro: “Volúmenes iguales de gases diferentes, en las mismas condiciones de presión y temperatura, contienen el mismo número de moléculas”; en los dos recipientes tenemos el mismo número de moléculas.
En el primer recipiente hay 2 gramos de oxígeno, que calculando el número de moles al que corresponde esta cantidad, usando factores de conversión:
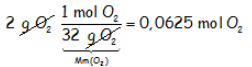
Donde hemos considerado que la masa molecular del oxígeno gaseoso es 32 uma, con lo que un mol de oxígeno equivale a 32 gramos de oxígeno. Recordar que “un mol equivale a la masa atómica –o molecular- expresada en gramos”.
Para obtener el número de moléculas que corresponden a esos 0,0625 mol de oxígeno, utilizaremos otro factor de conversión, teniendo en cuenta que 1 mol contiene un Número de Avogadro de moléculas, esto es, 6,022·1023 moléculas.
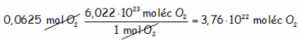
En consecuencia tendremos esta misma cantidad de moléculas de hidrógeno, por lo tanto, utilizando factores de conversión encadenados para obtener los gramos de hidrógeno:

Se ha hecho razonando como posiblemente lo haría un alumno, pero se podría haber abreviado bastante, considerando que si hay el mismo número de partículas, hay el mismo número de moles. Por lo tanto si tenemos 0,0625 mol de oxígeno tenemos 0,625 mol de hidrógeno, que pasándolos a gramos:
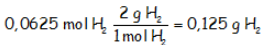
Que salvando el redondeo nos devuelve el mismo resultado.
EJERCICIO FQ1BE2013:
Sabiendo que la densidad del agua pura es 1 g/mL
a.- Hallar la cantidad de moléculas que hay en 3,5 mL de agua.
b.- Hallar la cantidad de átomos de hidrógeno en esa misma cantidad (3,5 mL)
c.- Hallar la cantidad de átomos de oxígeno en esa cantidad (3,5 mL)
DATOS: Ma(H) = 1 uma; Ma(O) = 16 uma.
APARTADO A, de la cantidad de moléculas de agua en 3,5 mL de agua:
La densidad del agua nos la aportan como dato, aunque en la mayoría de los ejercicios se da por supuesto que se conoce, si no en g/L, en kg/m3 o en kg/L, a saber, en estas unidades mencionadas:
densidad agua = 1 g/mL; densidad agua = 1000 kg/m3; densidad agua = 1 kg/L
Con el dato que nos dan, entonces, y utilizando factores de conversión, la masa que corresponde a los 3,5 mL de agua:
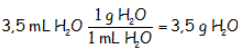
Lo cual es evidente ya que un mL de agua es un g de agua.
Teniendo en cuenta que la masa molecular expresada en unidades de masa atómica (uma) coincide numéricamente con la masa de un mol de moléculas expresada en gramos, en el caso del agua, que tiene una masa molecular de 18 uma, un mol de moléculas tiene una masa de 18 gramos. A su vez, en un mol de moléculas hay un número de Avogadro de moléculas (6,022·1023 moléculas). Por ello y utilizando factores de conversión:
![]()
APARTADO B, de los átomos de hidrógeno contenidos en esa misma cantidad de agua:
Como en una molécula de agua (H2O) hay dos átomos de hidrógeno, mediante factores de conversión (aunque no son necesarios por la sencillez de la operación lo hacemos aquí para trabajar el concepto FACTOR DE CONVERSIÓN):
![]()
APARTADO C, de los átomos de oxígeno presentes en esa misma cantidad de agua:
Sencillamente el mismo número que tenemos de moléculas, ya que por cada molécula de agua hay un átomo de oxígeno:
1,17·1023 átomos de oxígeno !!
