FACTORES CONVERSIÓN CANTIDAD QUÍMICA
FACTORES DE CONVERSIÓN EN OBTENCIÓN DE CANTIDADES EN QUÍMICA:

 PODRÍA INTERESAR LA CONSULTA DE LOS SIGUIENTES ARTÍCULOS RELACIONADOS:
PODRÍA INTERESAR LA CONSULTA DE LOS SIGUIENTES ARTÍCULOS RELACIONADOS:
-
- FACTORES DE CONVERSIÓN
- FACTORES DE CONVERSIÓN EN CAMBIOS DE UNIDADES DE FÍSICA Y QUÍMICA
- FACTORES DE CONVERSIÓN Y NOTACIÓN CIENTÍFICA. CAMBIOS DE UNIDADES EN FÍSICA Y QUÍMICA
- FACTORES DE CONVERSIÓN EN OBTENCIÓN DE CANTIDADES EN QUÍMICA
- RESOLUCIÓN DEL EJERCICIO FQ1BE1505 DE USO DE FACTORES DE CONVERSIÓN EN CÁLCULOS CON DISOLUCIONES
- FACTORES DE CONVERSIÓN EN REACCIONES QUÍMICAS. ESTEQUIOMETRÍA
ESTE MATERIAL SIGUE LOS PROCESOS DETERMINADOS POR:
INTERESA TENER EN CUENTA LO SIGUIENTE:
MOL: La palabra MOL indica una cantidad. Del mismo modo que la palabra MIL equivale a la cantidad 1.000; la palabra MILLÓN equivale a la cantidad 1.000.000; la palabra MOL equivale a la cantidad 6,022 × 1023 , que es el Número de Avogadro. Aunque se hace y nosotros lo hacemos, no admite plural, se debe decir: 3 mol, no 3 moles, en fin…
El Número de Avogadro es una constante e igual a: N.A. = 6,022 · 1023, cuya importancia radica en el hecho de que es el número de átomos, que hay en una masa en gramos, equivalente a la masa atómica del elemento en cuestión; o el número de moléculas, que se contienen en una masa en gramos, equivalente a la masa molecular de la sustancia en cuestión.
Partiendo de esto, se define un mol, como el Número de Avogadro de partículas… o de lo que sea.
Esto es:
-
-
- 1 mol de átomos son 6,022·1023 átomos
- 1 mol de moléculas son 6,022·1023 moléculas
- 1 mol de euros son 6,022·1023 euros, una pasada de euros… 602,200,000,000,000,000,000,000 euros.
-
CONCLUSIONES RESPECTO A ÁTOMOS:
-
- 6,022·1023 átomos de hidrógeno tienen una masa de 1 gramo, ya que la masa atómica del átomo de hidrógeno es de 1 u.m.a.
- 6,022·1023 átomos de oxígeno tienen una masa de 16 gramos, ya que la masa atómica del átomo de oxígeno es de 16 u.m.a.
CONCLUSIONES RESPECTO A MOLÉCULAS:
-
- 6,022·1023 moléculas de hidrógeno (H2) tienen una masa de 2 gramos, ya que la masa molecular de la MOLÉCULA de hidrógeno (H2) es de 2 uma (1·2=2).
- 6,022·1023 moléculas de hidrógeno (O2) tienen una masa de 32 gramos, ya que la masa molecular de la MOLÉCULA de oxígeno (O2) es de 32 uma (16·2=32).
- 6,022·1023 moléculas de Agua (H2O) tienen una masa de 18 gramos, ya que la masa molecular de la MOLÉCULA de agua (H2O) es de 18 uma (1·2+16=18).
- Podemos incluso decir que un mol de motos son 6,022 × 1023 motos; que 5 moles de motos tienen 5 x 2 x 6,022 × 1023 ruedas.
- Podemos decir que un mol de coches tiene 4 x 6,022 × 1023 ruedas. Sólo que esta cantidad, tremenda cantidad, sólo se utiliza en química.
Por ello un mol de moléculas de agua (H2O) tiene dos moles de átomos de hidrógeno y un mol de átomos de oxígeno. Entonces tiene 2 x 6,022 × 1023 átomos de hidrógeno y 6,022 × 1023 átomos de oxígeno. (fijarse en que una molécula de agua tiene dos átomos de hidrógeno y un átomo de oxígeno)
n (nº de moles) = gramos / Masa Molecular (o atómica)
EJERCICIO FQ3EE3237:
¿Cuántos moles de agua hay en 1 gramo de agua?
DATOS: Ma(H) = 1 uma; Ma(O) = 16 uma.
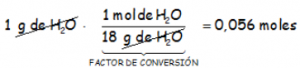
EJERCICIO FQ3EE3238:
¿Cuántas moléculas de agua hay en 1 gramo de agua?
DATOS: Ma(H) = 1 uma; Ma(O) = 16 uma.

O podemos incluso hacerlo paso a paso:

EJERCICIO FQ3EE3239:
¿Cuántos átomos de Hidrógeno hay en un gramo de agua?
DATOS: Ma(H) = 1 uma; Ma(O) = 16 uma.
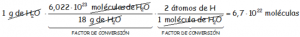
EJERCICIO FQ1BE2012:
Disponemos de dos recipientes con el mismo volumen y en los que se dan idénticas condiciones de presión y temperatura. Si en el primero hay 2 gramos de oxígeno, y en el segundo hay una cantidad de hidrógeno indeterminada. ¿Cuántos gramos de hidrógeno hay en el segundo?.
DATOS: Ma(H) = 1 uma; Ma(O) = 16 uma.
EJERCICIO FQ1BE2013:
Sabiendo que la densidad del agua pura es 1 g/mL
a.- Hallar la cantidad de moléculas que hay en 3,5 mL de agua.
b.- Hallar la cantidad de átomos de hidrógeno en esa misma cantidad (3,5 mL)
c.- Hallar la cantidad de átomos de oxígeno en esa cantidad (3,5 mL)
DATOS: Ma(H) = 1 uma; Ma(O) = 16 uma.
