INTRODUCCIÓN EQUILIBRIO QUÍMICO BACHILLERATO
INTRODUCCIÓN A EQUILIBRIO QUÍMICO:
Cuando en una reacción química realizamos los cálculos habituales preguntándonos: ¿qué cantidad de determinado producto se obtiene con una cantidad de determinado reactivo?, damos por supuesto que los reactivos desaparecen completamente y se forman los productos, como si de una reacción explosiva se tratase, o como si fuera una reacción irreversible que discurre en un único sentido «→» (los reactivos forman los productos).
En la realidad no ocurre así. En la mayoría de las reacciones químicas, reactivos y productos conviven en diferentes proporciones dependiendo de las condiciones.
La mayoría de las reacciones son reversibles y transcurren en las dos direcciones «⇄» de tal manera que cuando se alcanza el equilibrio, reactivos y productos se encuentran presentes en diferentes proporciones, intercambiándose unos por otros en un proceso dinámico en el que las proporciones de los diferentes compuestos se mantienen constantes, dependiendo esas concentraciones de las condiciones en las que transcurre la reacción.
Intentaremos incorporar esta idea al estudio de las reacciones químicas.
CIENCIA CON CONCIENCIA:
«El equilibrio químico de la atmósfera posee un índice muy alto de entropía, de desorden. Cuando se encuentra una atmósfera con una baja entropía, en la que hay demasiado metano, o demasiado oxígeno, o cualquier otro ordenamiento químico anómalo, eso indica la presencia de vida. Porque es la vida la que altera el equilibrio químico y lo ordena»
James Lovelock, científico inglés.
INTERIORIZO PROCESOS Y VALORES (PERFIL DE SALIDA DEL ALUMNADO)
VÍDEO RESUMEN CON TODO LO IMPORTANTE DE EQUILIBRIO QUÍMICO: https://youtu.be/2q61cjOGJF8
EL EQUILIBRIO QUÍMICO:
El equilibrio químico es un concepto fundamental en la química que se estudia en el segundo año de Bachillerato en España.
Este fenómeno ocurre cuando una reacción química alcanza un estado en el cual la concentración de los productos y los reactivos permanece constante con el tiempo. Esto no significa que la reacción haya cesado, sino que las velocidades de las reacciones directa e inversa son iguales, lo que lleva a la estabilidad de las concentraciones de las sustancias químicas involucradas.
Para comprender el equilibrio químico, es esencial familiarizarse con la Ley de Acción de Masas y la constante de equilibrio (K).
La ley de acción de masas se expresa de la siguiente manera para una reacción genérica:
a A + b B ⇌ c C + d D
Donde:
‘a’ y ‘b’ son los coeficientes estequiométricos de los reactivos (A y B).
‘c’ y ‘d’ son los coeficientes estequiométricos de los productos (C y D).
La constante de equilibrio (K) se define como la relación de las concentraciones de los productos (C y D) dividida por las concentraciones de los reactivos (A y B) en una reacción química en equilibrio. Matemáticamente, se expresa como:
K = [C]c [D]d / [A]a [B]b
Cuando K es mucho mayor que 1, significa que la reacción está favorecida hacia la formación de productos. Si K es mucho menor que 1, la reacción se encuentra favorecida hacia los reactivos. Cuando K está cerca de 1, la reacción está en un estado de equilibrio dinámico, con la formación de productos y reactivos al mismo ritmo.
Cuando K es mucho mayor que 1, significa que la reacción está favorecida hacia la formación de productos. Si K es mucho menor que 1, la reacción se encuentra favorecida hacia los reactivos. Cuando K está cerca de 1, la reacción está en un estado de equilibrio dinámico, con la formación de productos y reactivos al mismo ritmo.
Un ejemplo simple de equilibrio químico es la descomposición del dioxígeno (O2) en oxígeno atómico (O) a alta temperatura:
2 O2 ⇌ 2 O
Para esta reacción, la constante de equilibrio K se expresa como:
K = [O]2 / [O2]2
El equilibrio químico es un concepto crucial que permite a los químicos predecir el comportamiento de las reacciones y ajustar las condiciones para obtener los resultados deseados en diversos procesos químicos. En futuras lecciones, exploraremos cómo cambiar la temperatura, la presión y la concentración de reactantes afecta el equilibrio químico y cómo podemos utilizar este conocimiento en la práctica.
Ahora que hemos introducido el concepto de equilibrio químico, es fundamental explorar más a fondo cómo funciona y cómo podemos predecir y modificar las condiciones para influir en este equilibrio. Para ello, planteemos algunas preguntas y razonamientos clave:
Pregunta 1: ¿Qué sucede a nivel molecular durante un equilibrio químico?
Razonamiento 1: Durante una reacción química en equilibrio, las moléculas de los reactivos se están convirtiendo en productos al mismo ritmo que las moléculas de los productos se están convirtiendo en reactivos. Esto crea un estado dinámico en el que aparentemente nada cambia a nivel macroscópico, pero a nivel microscópico, las moléculas están en constante movimiento y cambio.
Pregunta 2: ¿Cómo podemos predecir la dirección en la que se desplazará el equilibrio químico?
Razonamiento 2: La dirección en la que se desplaza el equilibrio químico puede predecirse utilizando la constante de equilibrio (K) que mencionamos anteriormente. Si conocemos las concentraciones iniciales de los reactivos y productos, y sabemos el valor de K, podemos determinar si la reacción está favorecida hacia los productos, los reactivos o está en equilibrio.
Pregunta 3: ¿Cómo afecta la concentración de reactantes o productos al equilibrio químico?
Razonamiento 3: Cambiar la concentración de reactivos o productos puede desplazar el equilibrio químico en una dirección específica. Si aumentamos la concentración de reactantes, la reacción se desplazará hacia los productos para consumir los reactivos adicionales. Por el contrario, si aumentamos la concentración de productos, la reacción se desplazará hacia los reactivos. Esto se conoce como el principio de Le Chatelier.
Pregunta 4: ¿Cómo influyen la temperatura y la presión en el equilibrio químico?
Razonamiento 4: La temperatura y la presión también pueden influir en el equilibrio químico. Aumentar la temperatura favorecerá la reacción endotérmica (absorción de calor) y desfavorecerá la reacción exotérmica (liberación de calor). Cambiar la presión afecta principalmente a las reacciones en las que intervienen gases. Estos cambios en la temperatura y la presión pueden alterar el valor de K y, por lo tanto, el estado de equilibrio.
Estas preguntas y razonamientos nos proporcionan una base sólida para explorar más en profundidad el equilibrio químico. Investigaremos ejemplos concretos de reacciones en equilibrio, calcularemos constantes de equilibrio, y utilizaremos el principio de Le Chatelier para predecir y controlar cambios en las condiciones de equilibrio. ¡El equilibrio químico es un aspecto apasionante de la química que nos permite comprender y controlar una amplia gama de fenómenos en el mundo que nos rodea!
COMENZAMOS:
Planteamos la siguiente situación, enfocada como ejercicio:
EJERCICIO Q2BE2430: Tarea de introducción y conocimiento de estrategias de análisis del equilibrio químico.
En un recipiente de 15 litros, donde pretendemos que se inicie la reacción de formación del amoniaco, para su producción a nivel industrial, se introducen 1,2 mol de nitrógeno, 3 mol de hidrógeno y 0,3 mol de amoniaco.
Se aumenta la temperatura y se observa en el equilibrio que la cantidad de amoniaco ha aumentado a 1,9 mol.
Hallar la cantidad de hidrógeno y nitrógeno en el equilibrio.
RESOLUCIÓN:
Del enunciado deducimos que la reacción que se está considerando es:
N2 (g) + 3 H2 (g) ⇄ 2 NH3 (g)
Donde hemos supuesto que todos los compuestos presentes están en el mismo estado -gaseoso- (EQUILIBRIO HOMOGÉNEO).
La forma de visualizar la situación puede reflejarse en el siguiente cuadro, donde reflejamos las cantidades en mol: iniciales, las que reaccionan y las que quedan en el equilibrio.
Se indica que la cantidad de amoniaco ha aumentado, con lo que el sentido de la reacción, desde el inicio hasta el equilibrio es hacia la derecha: esto es, se genera cantidad adicional de producto a cuenta de que desaparecen cantidades de reactivo. En consecuencia notar lo indicado en la fila REACCIONA.
«Los coeficientes estequiométricos de la reacción nos indican que en el sentido en el que transcurre la reacción, por cada mol de nitrógeno que desaparece, desaparecen además tres mol de hidrógeno y se forman 2 mol de amoniaco», esto lo indicamos con -x, -3x, +2x.
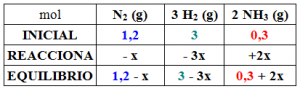
Como resulta que se conoce que la cantidad de amoniaco en el equilibrio es de 1,9 mol:
0,3 + 2x = 1,9 ⇒ 2x = 1,9 – 0,3 ⇒ 2x = 1,6 ⇒ x = 1,6/2 =0,8 mol
Por ello los mol de nitrógeno e hidrógeno:
nH2 = 1,2 – x = 1,2 – 0,8 = 0,4 mol de H2
nN2 = 3 -3x = 3 – 3·0,8 = 0,6 mol de N2
Planteamos ahora esta nueva situación, igualmente enfocada como ejercicio:
EJERCICIO Q2BE2431:
En un recipiente de 15 litros, donde pretendemos estudiar el equilibrio en la reacción de formación del amoniaco, se introducen 1,2 mol de nitrógeno, 2 mol de hidrógeno y 4 mol de amoniaco.
Se aumenta la temperatura y se observa en el equilibrio que la cantidad de amoniaco ha disminuido hasta 1,8 mol.
Hallar la cantidad de hidrógeno y nitrógeno en el equilibrio.
RESOLUCIÓN:
Del enunciado deducimos que la reacción que se está considerando es:
N2 (g) + 3 H2 (g) ⇄ 2 NH3 (g)
La forma de visualizar la situación puede reflejarse en el siguiente cuadro, donde reflejamos las cantidades en mol: iniciales, las que reaccionan y las que quedan en el equilibrio.
Se indica que la cantidad de amoniaco ha disminuido, con lo que el sentido de la reacción, desde el inicio hasta el equilibrio es hacia la izquierda: esto es, se genera cantidad adicional de reactivo a cuenta de que desaparecen cantidades de producto. En consecuencia notar lo indicado en la fila REACCIONA.
«Los coeficientes estequiométricos de la reacción nos indican que en el sentido en el que transcurre la reacción, por cada 2 mol de amoniaco que desaparece, se forma 1 mol de nitrógeno y tres mol de hidrógeno», esto lo indicamos con -2x, +x, +3x en cada uno de los casos.
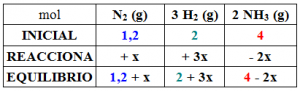
Como resulta que se conoce que la cantidad de amoniaco en el equilibrio es de 1,8 mol:
4 – 2x = 1,8 ⇒ -2x = 1,8 – 4 ⇒ 2x = 2,2 ⇒ x = 1,1 =1,1 mol
Por ello los mol de nitrógeno e hidrógeno:
nH2 = 1,2 + x = 1,2 + 1,1 = 2,3 mol de H2
nN2 = 2 + 3x = 2 + 3·1,1 = 5,3 mol de N2
EJERCICIO Q2BE2639:
El CO2 reacciona rápidamente con H2S según la reacción:
CO2 (g) + H2S (g) ⇄ COS (g) + H2O (g)
En un experimento se colocaron 0,1 mol de CO2 en 2,5 L a 337 ºC y una cantidad suficiente de H2S para que la presión total en el equilibrio sea 10 atm. Sabiendo que en la mezcla final había 0,01 mol de H2O (g):
a) ¿Qué cantidad hay del resto en el equilibrio?
b) Calcula la constante Kc.
IR A LA RESOLUCIÓN DE ESTE EJERCICIO DE EQUILIBRIO QUÍMICO
EJERCICIO Q2BE2640:
Una mezcla gaseosa de 1 L, constituida inicialmente por 7,94 mol de hidrógeno gaseoso, H2, y 5,30 mol de yodo gaseoso, I2, se calienta a 445 ºC.
En el equilibrio se forman 9,52 mol de yoduro de hidrógeno también gaseoso.
a) Calcula el valor de la constante de equilibrio Kc a dicha temperatura.
b) Si hubiésemos partido de 4 mol de hidrógeno gaseoso y 2 mol de yodo gaseoso, ¿cuántos moles de yoduro de hidrógeno gaseoso habría en el equilibrio?
IR A LA RESOLUCIÓN DE ESTE EJERCICIO DE EQUILIBRIO QUÍMICO
EJERCICIO Q2BE2722:
Se prepara una disolución de ácido acético [ácido etanoico] de concentración 5,5 · 10-2 M.
a) Calcula el grado de disociación del ácido acético en esta disolución y su pH.
b) Calcula la concentración del ión acetato [ión etanoato] en el equilibrio.
DATO: Ka (ácido etanoico) = 1,8 · 10-5 .
IR AL ARTÍCULO CON LA RESOLUCIÓN PASO A PASO DEL EJERCICIO: EXAMEN RESUELTO DE QUÍMICA DE 2º DE BACHILLERATO. EQUILIBRIO QUÍMICO, ÁCIDO BASE, REDOX, PILAS
EJERCICIO Q2BE2725:
Dado el siguiente equilibrio para la obtención de hidrógeno:
CH4 (g) ⇄ C (s) + 2H2 (g) ∆H>0
a) Escriba la expresión de la constante de equilibrio Kp.
b) Justifique cómo afecta una disminución del volumen de reacción a la cantidad de H2(g)
c) Justifique como afecta un aumento de la temperatura a la cantidad de H2 (g)
IR AL ARTÍCULO CON LA RESOLUCIÓN PASO A PASO DEL EJERCICIO: EXAMEN RESUELTO DE QUÍMICA DE 2º DE BACHILLERATO. EQUILIBRIO QUÍMICO, ÁCIDO BASE, REDOX, PILAS
EJERCICIO Q2BE2796:
Para el equilibrio en el que el gas bromuro de hidrógeno genera bromo e hidrógeno gaseoso, responder a las siguientes cuestiones, cuando se parte de 1,2 moles de bromuro de hidrógeno en un volumen de hidrógeno:
a.- Hallar la concentración de las especies en equilibrio.
b.- Hallarel grado de disociación.
DATOS: Kc=7,7·10-5
VÍDEO CON LA SOLUCIÓN DEL EJERCICIO: https://www.youtube.com/watch?v=u6MMEy_XvA8

Comments are closed, but trackbacks and pingbacks are open.