LEYES DE LOS GASES
LEYES Y COMPORTAMIENTOS DE LOS GASES PARA SECUNDARIA Y BACHILLERATO:

Intentamos acercar el contenido de las Leyes de los Bases: Boyle-Mariotte, Gay-Lussac y Charles, con experiencias cotidianas, en los niveles en los que se introduce este contenido en la Secundaria.
En Gran Canaria estamos acostumbrados a observar el comportamiento de la bolsa de Papas, cuando lo llevamos desde el nivel del mar a nuestra Cumbre: la bolsa de papas se infla y parece que las papas bailan dentro de la bolsa. Esto sería una buena forma de iniciar el contenido. Lo anterior responde con bastante aproximación a la Ley de Boyle-Mariotte. Lo mismo cuando presionamos una jeringuilla tapando con el dedo la salida de aire, que notamos un aumento de la presión; o a la inversa, cuando estiramos la jeringuilla, que notamos una disminución de la presión, un efecto de vacío que nos intenta atrapar el dedo.
CIENCIA CON CONCIENCIA:
Debemos ser conscientes de que nuestros actos, incluso los más inocentes, pueden tener efectos perjudiciales para el medio ambiente. Ya que estamos con esto de los gases, pensemos que las sopladeras de helio, que compramos en los mercadillos para los más pequeños, o las que utilizamos para felicitar los cumpleaños, cuando las soltamos ascienden hasta que terminan explotando (por la disminución de presión a una altura) o bien deteriorándose y terminan cayendo al suelo (al mar posiblemente si estás como nosotros en las Islas Canarias). Estas sopladeras están hechas de plástico y de vivos colores, con lo que no es extraño que algún animal marino las ingiera, con el consiguiente daño.
INTERIORIZO PROCESOS Y VALORES (PERFIL DE SALIDA DEL ALUMNADO)
Del mismo modo, la olla a presión a Gay-Lussac y las bolsas de congelados que metemos en el microondas (si están cerradas) al comportamiento que describe Charles para los gases.
Se incluyen en el documento las gráficas correspondientes a cada una de las Leyes y un esquema medianamente atractivo de las mismas.
No siempre es fácil acercar los contenidos de Física y Química a los alumnos, aunque a través del acercamiento al APRENDIZAJE BASADO EN PROYECTOS en ocasiones se consigue.
Se propone a los alumnos grabar estas realidades a lo largo del curso, cuando se les presente la ocasión como actividad alternativa que se premia en términos de notas.
Se reflexiona sobre las consecuencias medioambientales de soltar sopladeras de helio a la atmósfera, que aumentan de volumen mientras suben (al disminuir la presión) y explotan convirtiéndose en un problema para el medio ambiente.
Del mismo modo y teniendo en cuenta que los canarios estamos acostumbrados a volar en avión, se comentan los comportamientos que muchos observan sobre las bolsas de papas o frutos secos que se suministran en los vuelos. (Ley de Boyle-Mariotte).
Utilizamos aquí la dinámica de documentos enciclopédicos, que los alumnos manejan en varios cursos, con actividades diferenciadas por curso. Esto permite que la actividad pueda ser considerada de refuerzo-ampliación, cuando se usa en un curso diferente para el que se diseña inicialmente.
EJERCICIOS PROPUESTOS DE APLICACIÓN DE LAS LEYES DE LOS GASES:
LAS LEYES DE LOS GASES:
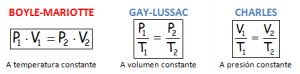
Las leyes de Gay-Lussac y de Charles nos indican que las magnitudes relacionadas en ellas son directamente proporcionales (al aumentar una aumenta la otra) por ello ponemos sus nombres en azul.
La Ley de Boyle-Mariotte nos indica que las magnitudes relacionadas en ella son inversamente proporcionales (al aumentar la presión, disminuye el volumen) por ello hemos puesto su nombre en rojo.
ES MUY IMPORTANTE TENER EN CUENTA QUE LA MAGNITUD TEMPERATURA QUE APARECE EN LAS LEYES TIENE QUE ESTAR INDICADA EN GRADOS KELVIN (ESCALA DE TEMPERATURA ABSOLUTA), TENIENDO EN CUENTA QUE PARA PASAR A GRADOS KELVIN LOS GRADOS CENTÍGRADOS SE LE SUMA 273, YA QUE 0ºC = 273 K.
EJERCICIO FQ23EE2120:
En la punta una jeringuilla llena de aire hasta un volumen de 5 ml colocamos el dedo de manera que no se escape el aire y apretamos hasta que conseguimos mantener la jeringuilla en un volumen de 3 ml.
Hallar la presión a la que se encontrará el aire cuando la jeringuilla se presiona hasta los 3 ml.
Nombrar la ley de los gases que describe este comportamiento.
SUPOSICIONES NECESARIAS:
La experiencia se realiza a temperatura constante, la del ambiente en ese momento.
Suponemos que el aire se comporta como un gas ideal.
Como al inicio, cuando ocupa un volumen de 5 ml, la boca de la jeringuilla está abierta, se entiende que la presión en ese momento es la atmosférica.
VÍDEO QUE RESUELVE EL EJERCICIO: https://youtu.be/4ZQdF47ZCNE
EJERCICIO FQ23EE2121:
Cuando sancochamos (cocinamos con agua) en un caldero a tapa descubierta la temperatura una vez ha comenzado a hervir es de 100 o y se mantendrá ahí mientras haya agua hirviendo, aunque le demos más calor.
Las ollas a presión domésticas permiten, gracias a que están cerradas, impidiendo que se escape el vapor, que la temperatura de cocción aumente hasta los 120 o.C, con lo que se reducen los tiempos de cocción con el consiguiente ahorro de energía y de pérdida de nutrientes por este proceso. La utilización de la olla express es por tanto un modo de ahorro de energía y de aprovechamiento de los nutrientes. En cualquier caso, siempre teniendo en cuenta las medidas de seguridad necesarias.
Una olla a presión y su contenido se encuentra a una temperatura ambiente de 25o C en el momento en que cerramos la tapa.
EJERCICIO FQ2EE2400:
Hallar la presión a la que se encontrará cuando alcanza una temperatura de 120 o C, suponiendo que no ha habido ninguna pérdida de vapor en el proceso y considerando el vapor de agua como un gas ideal.
Indicar la Ley de los gases que describe este comportamiento.
VÍDEO DONDE SE RESUELVE EL EJERCICIO: https://youtu.be/ght9VJeBuPk
EJERCICIO FQ23EE2122:
Cuando aumentamos la temperatura de un gas, éste aumenta de volumen. Lo podemos observar cuando en un recipiente de conservación de alimentos ponemos algo caliente y lo tapamos con un film de plástico, observamos que se abomba hacia afuera, como consecuencia del aumento de volumen del vapor contenido en el recipiente.
En un recipiente de 700 ml, tenemos un gas que ejerce una presión de 700 mm de Hg estando a 50ºC.
¿Qué volumen ocupará cuando el gas se encuentre a 70ºC, si se mantiene constante la presión?
Indicar la ley que describe ese comportamiento.
VÍDEO QUE RESUELVE EL EJERCICIO: https://youtu.be/0kNxk-kSwjE
AMPLIAMOS ESTE CONTENIDO RELATIVO AL COMPORTAMIENTO DE LOS GASES:
Si pensamos un poco, las tres leyes de los gases, se podrían limitar a una única ecuación, denominada ECUACIÓN GENERAL DE LOS GASES IDEALES:
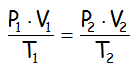
Ya que si nos encontramos con que la temperatura es constante, T1 y T2 valen lo mismo, con lo que se pueden simplificar y queda la Ley de Boyle-Mariotte. Si el volumen es constante, pues lo mismo, podremos simplificarlo y nos quedaría la Ley de Gay Lussac. Y si es la presión la que es constante, pues llegamos a la Ley de Charles:
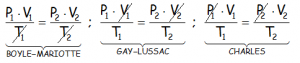
Esto nos hace ver que el cociente siguiente es constante:
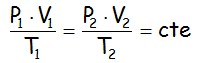
Y se comprueba que esa constante es igual al número de moles (n) por una constante (R), cuyo valor depende de las unidades consideradas, que recolocando nos llega a la ECUACIÓN DE ESTADO DE LOS GASES IDEALES:
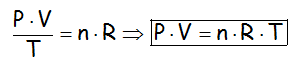
En la que el valor de R más utilizado es de 0,082, cuando la presión se mide en atmósferas, el volumen en litros y la temperatura en Kelvin, ya que:
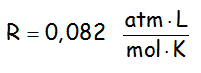
De ahí que insistamos en que en las tres leyes de los gases, aunque no sea necesario, pongamos el volumen en litros y la presión en atmósferas. LA TEMPERATURA SIEMPRE EN KELVIN.
Esperamos que pueda ser considerada una actividad dentro del APRENDIZAJE BASADO EN PROYECTOS (A.B.P.)
SE CONTEMPLAN LOS ASPECTOS RELACIONADOS CON EL PERFIL DE SALIDA DEL ALUMNADO DE LOS INSTITUTOS DIOCESANOS DE CANARIAS
PUEDE INTERESAR VER: ECUACIÓN DE ESTADO DE LOS GASES IDEALES. ECUACIONES DE PRIMER GRADO
RECURSOS EN FORMATO PDF, PARA CONSULTAR:
51 LEYES DE LOS GASES V5PODRÍA INTERESAR LA VISITA AL SIGUIENTE ARTÍCULO DEL PROYECTO, DONDE SE DESARROLLAN LAS ASIGNATURAS DE FÍSICA Y QUÍMICA DE SECUNDARIA Y BACHILLERATO:

Comments are closed, but trackbacks and pingbacks are open.