TERMOQUÍMICA HESS QUÍMICA BACHILLERATO
TERMOQUÍMICA, PARA QUÍMICA DE BACHILLERATO. RECURSOS AUDIOVISUALES:
SE PRETENDE CON ESTA DINÁMICA EL DESARROLLO DE LAS COMPETENCIAS:
- COMPETENCIA MATEMÁTICA Y EN CIENCIA, TECNOLOGÍA E INGENIERÍA (STEM), concretamente los DESCRIPTORES OPERATIVOS STEM1 , STEM2 , STEM4
- COMPETENCIA EN CONCIENCIA Y EXPRESIÓN CULTURALES (CCEC), concretamente el DESCRIPTOR OPERATIVO CCEC2 y EL DESCRIPTOR OPERATIVO CCEC4.2
- COMPETENCIA EN COMUNICACIÓN LINGÜÍSTICA (CLL), concretamente los DESCRIPTORES OPERATIVOS CCL2 , CCL3.
- COMPETENCIA DIGITAL (CD), concretamente el DESCRIPTOR OPERATIVO CD1 y CD3
- COMPETENCIA EMPRENDEDORA (CE), concretamente el DESCRIPTOR OPERATIVO CE1
- COMPETENCIA PERSONAL, SOCIAL Y DE APRENDER A APRENDER (CPSAA), concretamente el DESCRIPTOR OPERATIVO CPSAA1.1 , CPSAA4 , CPSAA5
- COMPETENCIA PLURILINGÜE, concretamente los DESCRIPTORES OPERATIVOS CP1 , CP2
EJERCICIO F1BE2076:
Teniendo en cuenta la siguiente reacción, de formación del agua, en la que se incluye la entalpía correspondiente:
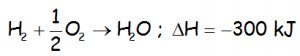
a.- Hallar la energía que se desprende cuando se forman 2 moles de agua.
b.- Hallar la energía que se desprende cuando se forman 4 gramos de agua.
c.- Hallar la masa de agua que se tiene que formar para que se desprendan 1500 kJ.
DATOS DE MASAS ATÓMICAS EN U.M.A.: Ma(H)=1; Ma(O)=16
VÍDEO QUE RESUELVE EL EJERCICIO: https://youtu.be/6t_UP4bLDF0
EJERCICIO F1BE2077:
Teniendo en cuenta la siguiente reacción, de formación del agua, en la que se incluye la entalpía correspondiente:
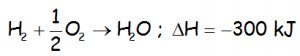
Hallar la energía que se desprende cuando se intenta formar agua con 5 g de hidrógeno y 5 gramos de oxígeno.
DATOS DE MASAS ATÓMICAS EN U.M.A.: Ma(H)=1; Ma(S)=32 ; Ma(O)=16
SOLUCIÓN: Se desprenden 93,75 kJ
EJERCICIO FQ1BE2090:
Sabiendo que la entalpía de combustión del etanol es -764 kJ/mol.
a.- Escribir y ajustar la reacción de combustión del etanol, añadiendo la entalpía correspondiente, lo que la convierte en una ecuación termoquímica.
b.- Con lo que se ha aportado, indicar si la reacción de combustión del etanol es exotérmica o endotérmica.
c.- Con lo que se ha aportado, indicar si en la combustión del etanol, se absorbe o se desprende energía.
d.- Hallar la energía que se desprende o se absorbe cuando se realiza la combustión de 25 gramos de etanol.
DATOS DE MASAS ATÓMICAS EN U.M.A.: C=12; H=1; O=16.
DIAGRAMAS DE ENTALPÍA. COMPARATIVA DE LOS DIAGRAMAS ENTÁLPICOS DE REACCIONES EXOTÉRMICAS Y ENDOTÉRMICAS.
Notar en las gráficas que se muestran, el hecho de que el valor de la variación de entalpía de la reacción en sentido inverso, cambia el signo. Si una reacción es endotérmica en un sentido, sería exotérmica en sentido inverso. Se muestran las reacciones que participan en el motor y en la pila de hidrógeno.
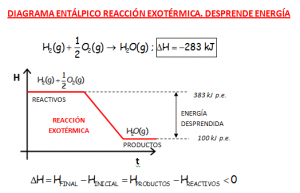
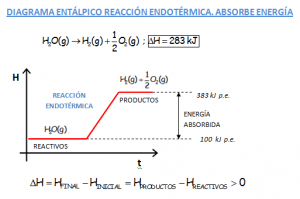
Ir al vídeo que explica lo indicado en las gráficas que se muestran: https://youtu.be/lmpYkg13Yi4
ENTALPÍA DE REACCIÓN A TRAVÉS DE LA LEY DE HESS:
«El cambio de energía calórica que acompaña a una reacción química a Volumen y presión constante, es independiente del número y naturaleza de los estados intermedios».
A un nivel operativo, podemos atrevernos a decir que: «cuando una reacción es combinación de otras reacciones, su entalpía es la combinación de las entalpías de las otras reacciones». Lo mejor será verlo en un ejemplo.
EJERCICIO F1BE2079:
Hallar la entalpía de la siguiente reacción:
![]()
Conociendo las entalpías de las reacciones:
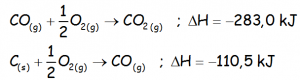
IR AL VÍDEO QUE RESUELVE EL EJERCICIO UTILIZANDO LA LEY DE HESS: https://youtu.be/8iSQMMITJto
EJERCICIO FQ1BE1205:
El metanol se obtiene industrialmente a partir de monóxido de carbono e hidrógeno según la reacción:
![]()
Calcular el cambio de entalpía para la reacción de síntesis industrial de metanol, teniendo en cuenta las siguientes ecuaciones termoquímicas:
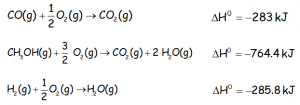
IR AL VÍDEO QUE RESUELVE EL EJERCICIO CON LA LEY DE HESS: https://youtu.be/Q0EgfPM8Zfg
ENTALPÍA DE REACCIÓN A TRAVÉS DE LAS ENTALPÍAS DE FORMACIÓN:
La entalpía normal de formación de un compuesto en condiciones estándar, también denominada calor de formación, se representará por ΔHºf, y se define como: el cambio de entalpía (variación de calor), ΔH, que tiene lugar cuando se forma un mol de compuesto a partir de los elementos que lo constituyen en sus estados de agregación más estables en condiciones estándar (1 atm de presión y 25º C de temperatura).
Con estos datos de entalpías normales de formación, podemos calcular la entalpía normal (en condiciones estándar) de una reacción, utilizando:
ΔH0reacción=Σnp·ΔHºf p – Σnr·ΔHºf r
Donde np y nr hacen referencia a los coeficientes estequiométricos de los productos y de los reactivos; ΔHºf p y ΔHºf r son las entalpías normales de formación de los productos y reactivos respectivamente.
«A la entalpía estándar de formación de los elementos en su estado estándar se les asigna la entalpía cero», ya que su formación no supone ningún proceso químico.
Algunos elementos en estado estándar, por lo tanto con entalpía de formación estándar con valor cero: O2 (g); C (grafito); H2 (g); Br2 (l); Fe (s); S (s); P (blanco); Hg (l); Al (s); Ca (s);
EJERCICIO F1BE427:
La entalpía estándar de formación de la glucosa (C6H12O6) es -1268 kJ/mol. La entalpía estándar de formación del agua líquida es -187,78 kJ/mol y la del anhídrido carbónico es -393,51 kJ/mol.
a.- Hallar la entalpía de combustión estándar de la glucosa.
b.- Indicar si la reacción de combustión es exotérmica o endotérmica.
c.- Hallar el calor asociado a la combustión de 8 gramos de glucosa.
SOLUCIÓN: -2219,74 kJ
PODRÍA INTERESAR LA CONSULTA DE LOS SIGUIENTES RECURSOS DE QUÍMICA 2º BACHILLERATO:

Comments are closed, but trackbacks and pingbacks are open.