CAMBIOS MATERIA REACCIONES QUÍMICAS
CAMBIOS EN LA MATERIA. INICIO A REACCIONES QUÍMICAS. PRIMEROS CURSOS DE SECUNDARIA. ACTIVIDAD 145 DEL PROYECTO ACHIMAGEC:
OBJETIVOS DE LA UNIDAD DE APRENDIZAJE:
Aprenderemos a distinguir cambio físico de cambio químico, conoceremos la Teoría atómica de Dalton, la Ley de Lavoisier de conservación de la masa, aprenderemos a expresar los cambios químicos como reacciones, ajustaremos las reacciones, realizaremos el balance de masas, profundizaremos en el concepto de elemento y compuesto/atómo y molécula; conoceremos el concepto de MOL, usaremos las reacciones para realizar cálculos con masas trabajando la proporcionalidad directa con reglas de tres y sobre todo con factores de conversión.
Tanto la realización del ajuste y del balance de masas como el tratamiento de la proporcionalidad directa con reglas de tres y factores de conversión son aspectos de mucho interés dentro del desarrollo de la competencia matemática.
UNIDAD DE APRENDIZAJE:
CAMBIO FÍSICO: Transformación en la que no varía la naturaleza de la materia. Antes y después del cambio la materia se representa por la misma fórmula química. El agua cuando cambia de estado sigue siendo agua (H2O).
CAMBIO QUÍMICO: Transformación en la que varía la naturaleza de la materia. Antes del cambio la materia se representa por una fórmula química y después por otra fórmula diferente. Cuando quemamos el metano en presencia de oxígeno, se produce el cambio a anhídrido carbónico y agua. Los cambios químicos se indican mediante REACCIONES QUÍMICAS.
El metano (CH4) es un compuesto químico, ya que está formado por los elementos carbono e hidrógeno. Elementos son los que aparecen en la tabla periódica. El hidrógeno es un elemento, y con su símbolo H, queremos representar un átomo de hidrógeno. El Metano es un compuesto, y con su fórmula CH4, queremos representar una molécula de metano, que está compuesta por un átomo de carbono y 4 átomos de hidrógeno.
Para Dalton, la materia estaba compuesta por partículas indivisibles que llamó átomos. Ahora sabemos que no son indivisibles: el átomo está formado por electrones, protones y neutrones.
COMBUSTIÓN DEL METANO, EJEMPLO DE CAMBIO QUÍMICO, DE REACCIÓN QUÍMICA:
El metano toma el oxígeno del aire, se quema, y produce anhídrido carbónico y vapor de agua:
![]()
Está claro que eso no cuadra, ¿han desaparecido hidrógenos?, ¿se han creado oxígenos?. Ni de broma.
LAVOISIER lo dejó claro: “la materia ni se crea ni se destruye, sólo se transforma” Ley de Lavoisier. Por ello, en un cambio químico, la suma de las masas de los reactivos tiene que ser igual que la suma de las masas de los productos.
![]()
Pues para que cuadre con la ley de Lavoisier hay que poner unos números delante de cada uno de los cuatro compuestos que intervienen para que coincidan el número de elementos de los reactivos con los de los productos. Eso se llama AJUSTAR UNA REACCIÓN QUÍMICA, y es imprescindible hacerlo antes de trabajar con ella. Notar que esos números mágicos son los que se muestran, ya que igualan los carbonos, hidrógenos y oxígenos antes y después de la flecha.
![]()
De la tabla periódica, si vemos los datos de las masas atómicas de cada uno de los elementos que intervienen en la reacción, que están en unidades de masa atómica (u.m.a.); Ma(C)=12 uma; Ma(H)=1 uma; Ma(O)=16 uma, podemos realizar el balance de masas en esta reacción:
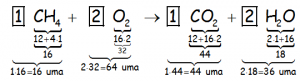
Numeritos que están en unidad de masa atómica, ya que estamos considerando en este caso que una molécula de metano reacciona con dos moléculas de oxígeno para producir una molécula de anhídrido carbónico y dos moléculas de agua, que son pequeñísimas.
Como podemos observar, se cumple la ley de Lavoisier: 16 uma + 64 uma = 44 uma + 36 uma
Pues bien, resulta que la u.m.a. es una unidad pequeñísima de masa, definida como la doceava parte de la masa de un átomo de carbono; equivalente a:
1 u.m.a. = 1,66054·10-27 kg = 1,66054·10-24 g
Lo que nos permite, teniendo en cuenta que es una división del gramo, ponerla directamente en gramos.
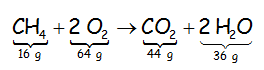
Cuando hacemos esto, ya no nos está indicando esta reacción una relación entre unas pocas moléculas, sino la relación entre un montón de ellas.
Veamos algo interesante al respecto, cogiendo por ejemplo el metano (CH4):
Sabiendo que la masa atómica de la molécula de metano es de 16 uma (12 del carbono y 4 de los hidrógenos) y teniendo en cuenta la relación entre la uma y el gramo (1 u.m.a. = 1,66054·10-24 g), con una regla de tres puedo saber la cantidad de moléculas que hay en los 16 gramos que hemos considerado:

Haciendo la regla de tres y hallando x, nos queda:
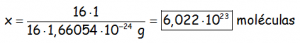
Fijarse en ese número, porque tiene nombre, es el NÚMERO DE AVOGADRO, que determina la cantidad de partículas que tiene 1 MOL.
1 MOL DE MOLÉCULAS CONTIENE 6,022·1023 MOLÉCULAS, del mismo modo que podemos decir que 1 MOL DE ÁTOMOS CONTIENE 6,022·1023 ÁTOMOS.
Y como hemos visto: cuando expresamos la masa molecular de un compuesto en gramos, esa masa contiene 6,022·1023 moléculas; y cuando expresamos la masa atómica de un elemento en gramos, esa masa contiene 6,022·1023 átomos.
Volviendo a nuestra reacción ajustada y hecho el balance de masas expresadas en gramos:
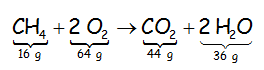
Debemos leerla diciendo que 1 mol de moléculas de metano reacciona con 2 mol de moléculas de oxígeno para formar 1 mol de moléculas de anhídrido carbónico y 2 mol de moléculas de agua.
Que en masas sería: 16 gramos de metano reaccionan con 64 gramos de oxígeno para producir 44 gramos de anhídrido carbónico y 36 gramos de agua.
Que como podemos comprobar, se cumple la Ley de Lavoisier: 16 g + 64 g = 44 g + 36 g. Siendo iguales la suma de las masas de los reactivos que la suma de las masas de los productos de la reacción.
Con ese balance de masas podemos obtener, cantidades de unos y de otros a nivel operativo. Por ejemplo,
EJERCICIO RESUELTO:
Hallar la cantidad de anhídrido carbónico que enviamos a la atmósfera, para aumentar el efecto invernadero, cuando quemamos 50 gramos de metano.
RESOLUCIÓN:
Partimos de la reacción ajustada y con balance de masas, que ha habíamos realizado,
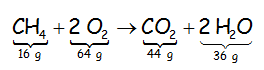
Con regla de tres:
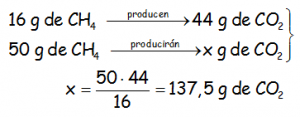
O mejor, con factores de conversión, que tienen un uso a la larga mucho más interesante:
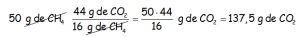
Notar como ponemos el dato, a continuación la rayita del factor de conversión, y ponemos la relación entre el que nos dan y el que nos piden que sale del balance de masas, teniendo en cuenta que se vaya lo que nos dan y se quede lo que nos piden.
EJERCICIOS PROPUESTOS:
1.- Teniendo en cuenta la reacción de combustión del metano, hallar la cantidad de oxígeno que se consume cuando quemamos 35 g de metano.
DATOS: Ma(C)=12 uma; Ma(H)=1 uma; Ma(O)=16 uma
2.- Teniendo en cuenta la reacción de combustión del metano, hallar la cantidad de vapor de agua que se genera cuando quemamos 25 g de metano.
DATOS: Ma(C)=12 uma; Ma(H)=1 uma; Ma(O)=16 uma
3.- Teniendo en cuenta la reacción de formación del agua a partir del hidrógeno y del oxígeno, hallar la cantidad de agua que podemos formar cuando reaccionan 15 gramos de hidrógeno.
DATOS: Ma(H)=1 uma; Ma(O)=16 uma
4.- Teniendo en cuenta la reacción de formación del agua a partir del hidrógeno y del oxígeno, hallar la cantidad de agua que podemos formar cuando reaccionan 15 gramos de oxígeno.
DATOS: Ma(H)=1 uma; Ma(O)=16 uma
5.- Hallar la cantidad de hidrógeno que ha reaccionado cuando se han formado 10 gramos de agua.
DATOS: Ma(H)=1 uma; Ma(O)=16 uma
6.- Hallar la cantidad de oxígeno que ha reaccionado cuando se han formado 10 gramos de agua.
DATOS: Ma(H)=1 uma; Ma(O)=16 uma
7.-EJERCICIO F2EE2195:
El nitrógeno y el hidrógeno gaseosos reaccionan para formar amoniaco. Partiendo de esta reacción de formación del amoniaco, hallar la cantidad de amoniaco que se produce cuando reaccionan 23 gramos de nitrógeno.
DATOS DE MASAS ATÓMICAS EN U.M.A.: Ma(N)=14; Ma(H)=1
IR AL VÍDEO QUE RESUELVE EL EJERCICIO: https://youtu.be/QxA30O5ZcmE
8.- El metanol se quema.
a.- Hallar la cantidad de vapor de agua (gramos) que enviamos a la atmósfera cuando se queman 23 g de metanol. (25,88 g)
b.- Hallar la cantidad de anhídrido carbónico (g) que enviamos a la atmósfera cuando se queman 23 g de metanol. (31,63 g)
c.- Hallar la cantidad de oxígeno (g) que se necesita para quemar 23 g de metanol. (34,5 g)
d.- Hacer comentarios a las cantidades obtenidas en los tres apartados anteriores.
DATOS: Ma(C)=12 uma; Ma(H)=1 uma; Ma(O)=16 uma
9.- Teniendo en cuenta la reacción de combustión del pentano (C5H12), responder a las siguientes preguntas, utilizando cualquiera de las estrategias matemáticas apropiadas (factores de conversión o reglas de tres):
a.- Hallar la cantidad de oxígeno que se necesita para que se quemen 57 g de pentano. (SOLUC.: 202,67 g)
b.- Hallar la cantidad de anhídrido carbónico que se obtiene cuando se queman 57 g de pentano. (SOLUC.: 174,17 g)
c.- Hallar la cantidad de agua que se obtiene cuando se queman 57 g de pentano. (SOLUC.: 85,5 g)
d.- Hacer comentarios a las cantidades obtenidas en los tres apartados anteriores, atendiendo a las indicaciones de la Ley de Lavoisier. (SOLUC.: observar que la suma de las cantidades de los reactivos coincide con la suma de las cantidades de los productos… 57+202,67=174,17+85,5)
DATOS: Ma(C)=12 uma; Ma(H)=1 uma; Ma(O)=16 uma
OTROS EJERCICIOS RESUELTOS DE CÁLCULOS CON MASAS EN REACCIONES QUÍMICAS, MEDIANTE MATERIAL AUDIOVISUAL:
CON LA REACCIÓN DE FORMACIÓN DEL AGUA:
CON LA COMBUSTIÓN DEL METANO: https://youtu.be/KwKt5sCnfTA
CON LA COMBUSTIÓN DEL PROPANO: https://youtu.be/oSfeCFU52Qw
CON LA COMBUSTIÓN DEL PROPANOL: https://youtu.be/qQdFFT2lXWA
EL MISMO CONTENIDO, PERO REALIZADO CON REGLAS DE TRES, PARA SU TRATAMIENTO DESDE LA ASIGNATURA DE MATEMÁTICAS, SE PUEDE CONSULTAR EN: PROPORCIONALIDAD DIRECTA EN REACCIONES QUÍMICAS. REGLAS DE TRES.

Comments are closed, but trackbacks and pingbacks are open.