PARTÍCULAS ELEMENTALES CONSTITUYENTES MATERIA
ACTIVIDAD INTERDEPARTAMENTAL FÍSICA Y QUÍMICA MATEMÁTICAS INGLÉS
PARTÍCULAS ELEMENTALES CONSTITUYENTES DE LA MATERIA:
LA ACTIVIDAD:
SUGERENCIAS PARA SU DESARROLLO:
Se propone para todos los cursos de la E.S.O., acordando su desarrollo según consideren los departamentos de Matemáticas y de Física y Química. En cursos superiores de la E.S.O. ampliar la complejidad de las actividades según corresponda y atendiendo a la diversidad del grupo.
PUEDE INTERESAR VER QUÍMICA BÁSICA, ESTRUCTURA DEL ÁTOMO, TABLA PERIÓDICA
ASPECTOS FORMALES PARA DOCENTES, AL FINAL DEL ARTÍCULO, PARA NO INTERFERIR CON LO QUE TIENE INTERÉS PARA EL APRENDIZAJE DE LOS ALUMNOS.
Dalton decía que la materia estaba constituída por partículas indivisibles, que llamó átomos.
Nada más lejos de la realidad, aunque en determinados procesos (algunas de las reacciones químicas) es como si la materia se comportara de esa forma. En esas reacciones, los compuestos, formados por átomos se transforman en otros, como consecuencia de una recolocación de átomos.
H2 + O2 → H2O ; pero claro, hay que ajustar, ya que no puede desaparecer un átomo de oxígeno, ya lo decía Lavoisier. (Ley de Lavoisier)
2 H2 + O2 → 2 H2O ; como se puede observar, aquí los átomos ( de oxígeno y de hidrógeno) se han comportado como indivisibles y lo que ha pasado es una recolocación de átomos.
Hoy se sabe que el átomo está formado por protones y neutrones (acumulados en su interior – núcleo-) y rodeados por electrones (mucho más pequeños y en movimiento en el exterior -corteza-)
En torno a la mitad del siglo pasado y como consecuencia del estudio de las radiaciones, del uso de los aceleradores de partículas, se descubrieron decenas de partículas subatómicas.
En esas fechas, Murray Gell-Mann y George Zweig propusieron una teoría en la que las partículas conocidas hasta ese momento resultaban ser combinación de otras partículas más elementales que denominaron quarks.
QUARKS:
Hay varios tipos, pero nos centraremos de momento en el quark up y en el quark down:
| TIPO DE QUARK | CARGA |
| quark up | +2/3 e |
| quark down | -1/3 e |
Donde e es la carga del electrón en valor absoluto y en unidades del S.I.; e=1,6·10-19 C
De hecho, los protones y los neutrones, que se denominan nucleones (por eso de que están en el núcleo) están formados por combinaciones de quarks, concretamente de 3 quarks.
APLICACIÓN DE LO ANTERIOR A LOS NÚMEROS RACIONALES:
CUESTIÓN 1: ¿Qué carga tendría una partícula formada por 3 quarks up?
CUESTIÓN 2: ¿Qué carga tendría una partícula formada por 3 quarks down?
CUESTIÓN 3: Teniendo en cuenta que el protón tiene una carga de +1 e, y que el neutrón no tiene carga, descubrir la combinación de quarks que constituye el protón y la que constituye el neutrón.
Los quarks no se observan aislados en la naturaleza, siempre aparecen unidos en grupos de dos, tres o más.
Aparte de los quarks up y down, que constituyen los nucleones, existen otros tipos de quarks: charm, strange, top y bottom.
APLICACIÓN A LA NOTACIÓN CIENTÍFICA, NOTACIÓN EXPONENCIAL:
Los siguientes números están en notación científica:
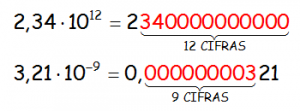
La nomenclatura científica es perfecta para los números grandes y pequeños, ya que nos dan idea del orden de la magnitud, fijándonos en el exponente del 10.
El número en notación científica 2,34·1012 consta de:
-
- Una parte entera formada por una sola cifra que no puede ser el cero: 2
- La parte decimal, que a falta de un criterio, tomaremos dos cifras después de la coma, redondeando si fuera necesario: ,34
- La potencia de base 10, que nos indica la magnitud del número: ·1012
Del mismo modo que 1000 = 103 y que 0,001 = 10-3 ; el número que identifica la carga del electrón en unidades del S.I. e=1,6·10-19 C = 0,00000000000000000016 C ; ó el número que corresponde a la masa de la Tierra en unidades del S.I. MT=5,972·1024 kg = 5972000000000000000000000 kg , nos dejan claro lo necesario de este tipo de notación, utilizando las potencias de diez.
La masa del protón mp+= 1,6726·10-27 kg ; masa del neutrón mn= 1,6749·10-27 kg ; me– = 9,11·10-31 kg
No se te ocurra pensar que es la suma de las masas de los quarks que componen a estos nucleones, ya que en la unión de los quarks intervienen las interacciones nucleares (fuerzas en las que la masa se convierte en energía según la ecuación de Einstein E=m·c2)
c es la velocidad de la luz, que en el S.I. c = 3·108 m/s
CUESTIÓN 4: ¿Cuál de los dos nucleones tiene mayor masa?.
CUESTIÓN 5: Colocar por orden de mayor a menor masa las correspondientes al protón, neutrón y electrón.
CUESTIÓN 6: Hallar en unidades del S.I. la masa del núcleo de tritio (isótopo del hidrógeno que tiene en el núcleo 2 neutrones y 1 protón).
Evidentemente, como si esos nucleones estuvieran aislados.
CUESTIÓN 7: Teniendo en cuenta que 1 u.m.a. =1.6605402·10-27 kg, y que el núcleo de tritio tiene una masa de 3,0160492 u.m.a., indicar si te sorprende el resultado de la cuestión 6 anterior.
CUESTIÓN 8: Intenta explicar la desviación observada en la cuestión 5 anterior.
PUEDE INTERESAR LA CONSULTA DE EXPLICACIÓN FUERZAS NUCLEARES
O BIEN INTERACCIÓN NUCLEAR FUERTE
APLICACIÓN A LA COMPOSICIÓN DE NÚCLEO ATÓMICO:
El número atómico Z indica el número de protones del núcleo, e identifica al elemento que aparece en la tabla periódica ordenado por ese número de protones. El número másico A corresponde al número de nucleones del elemento (número de protones + neutrones, ambos en el núcleo).
Tener en cuenta que si hablamos del átomo completo, el número de electrones de la corteza coincide con el número de protones de núcleo siempre y cuando el átomo sea neutro, sin carga neta. Cuando un átomo gana electrones se convierte en un ión negativo, cuando pierde en un ión positivo. LOS ELECTRONES ES LO QUE SE GANA O SE PIERDE, YA QUE EL NÚCLEO NO SE TOCA O …. ¡BUMMM!… BOMBA ATÓMICA.
Se expresa del siguiente modo: AZX , que en el caso de uno de los isótopos del azufre sería: 3016S .
CUESTIÓN 9: Indicar el número de protones y de neutrones que tiene el núcleo del isótopo del azufre mencionado 3016S , comprobando en la tabla periódica que efectivamente su posición es la del número atómico Z=16.
APLICACIÓN A LA PROPORCIONALIDAD DIRECTA:
CUESTIÓN 10: Consultando la tabla periódica, donde el número atómico Z indica el número de protones del núcleo, hallar la masa en kg que tendrían los protones del carbono, supuestos aislados*.
*Indicamos «supuestos aislados», ya que a estas alturas debemos saber que la masa de los protones de un núcleo, en el núcleo, se mantienen unidos gracias a la conversión de masa en energía, con lo que la masa total de protones en un núcleo es inferior a la suma de las masas de los protones que lo constituyen.
CUESTIÓN 11: Hallar para el isótopo del azufre 3016S , la masa total de sus nucleones, utilizando los datos de la masa del protón y del neutrón. (SOL.: 5.02102E-26 kg)
Debemos tener en cuenta que esta masa obtenida debe ser superior a la masa real del núcleo.
APLICACIÓN A UTILIZACIÓN DE FACTORES DE CONVERSIÓN:
CUESTIÓN 12: Los datos experimentales indican que la masa del núcleo del isótopo de azufre 3016S es de 29,984903 u.m.a. Utilizando el dato de conversión de u.m.a. a kg, hallar la masa del núcleo de este isótopo del azufre en kg. (SOL.: 4,97911E-26 kg)
Debemos tener en cuenta que esta masa obtenida debe ser inferior a la masa obtenida en la cuestión anterior.
CUESTIÓN 13: Buscar un argumento en todo lo expuesto anteriormente, que nos indique que la masa del protón y del neutrón, la masa de cada uno de ellos en u.m.a. es aproximadamente uno.
APLICACIÓN A ECUACIONES DE PRIMER GRADO:
UNIDADES DEL SISTEMA INTERNACIONAL:
CUESTIÓN 14: Teniendo en cuenta la ecuación de Einstein de conversión de masa en energía, y utilizando los datos necesarios que se encontrarán más arriba, hallar la energía correspondiente a la diferencia de masa del núcleo (defecto de masa), en el caso expuesto en la cuestión 12, que es la causante de que los protones y neutrones se mantengan unidos. Cuando todo está en unidades del S.I. la energía se mide en Julios (J).
CUESTIÓN 15: Hallar el defecto de masa que correspondería a un supuesto núcleo que tuviera una energía de enlace nuclear de 4,5·10-9 J. Indicar si este dato es razonable para otro isótopo del azufre.
Para cursos superiores, plantear un caso en el que haya que obtener la velocidad de la luz (ecuación de 2º grado incompleta).
ACTIVIDADES FINALES, DE CONSOLIDACIÓN:
CUESTIÓN 16: Elaborar con una hoja de cálculo el procedimiento para obtener la masa total de protones y neutrones de un núcleo cualquiera, aportando el número atómico y el número másico. (COMPETENCIA ESPECÍFICA MATEMÁTICA 4)
CUESTIÓN 17: Proponer con posterioridad a la evaluación de estos contenidos al profesor la dinámica de cooperativo EL ALUMNO HORCÓN. (COMPETENCIA ESPECÍFICA 10 PARA MATEMÁTICAS, COMPETENCIA ESPECÍFICA 5 PARA FÍSICA Y QUÍMICA).
CUESTIÓN 18: Para el átomo de Helio, dibujar el átomo, con todas sus partículas (protones, neutrones y electrones) en las posiciones correspondientes. Buscar su composición en la tabla periódica.
CUESTIÓN 19: Se estima que la distancia entre dos protones en un núcleo cualquiera es de 10-15 m. Calcular, utilizando la Ley de Coulomb, la fuerza electrostática de repulsión entre dos protones, en unidades del S.I.
SOLUC.: 230,4 N
CUESTIÓN 20: Con el valor de la fuerza obtenida en la cuestión anterior y utilizando la segunda Ley de Newton, hallar la aceleración a la que se verían sometidos los protones en el núcleo de no existir la fuerza de atracción nuclear consecuencia del defecto de masa.
SOLUC.: 1,37·1029 m/s
CUESTIÓN 21: Reflexionar acerca del valor obtenido en las dos cuestiones anteriores.
SOLUC.: «sin comentarios…»
QUESTION 22: What three particles make up an atom?. Choose 1 answer
-
- A.- Neutrons, photons and protons
- B.-Electrons, protons and positrons
- C.- Protons, neutrons and electrons
- D.- Photons, positrons and neutrons
QUESTION 23:
A.- Name each element in the drawing with the right word in the glossary: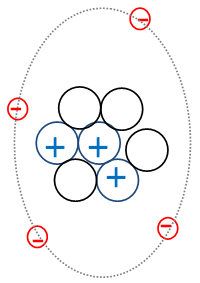
Glossary: neutrons, protons, electrons, nucleus, charge, neutral.
B.- Let’s compare the atom’s elements by using:
Bigger – small – powerful – slow – fast – important
To be – to have -there is/are
Write at least 5 sentences
Example: «The atom is bigger than the neutron»
C.- Translate the following definition: «Matter is anything that occupies space or has mass. Matter is made up of protons, neutrons and electrons. Atoms come together to form molecules, which are the building blocks for all types of matter.»
D.- Can you still remember the comparative forms? More……than; as…….as; less……..than
Then complete:
When the atom has a positive charge, it has more…………….. than………….
If the atom has less………….than………….we say it has a negative…………….
When th atom has as many……………..as………………we say the atom is…….
F. What is the element of the drawing?, you can check the periodic table.
CUESTIÓN 24 (FQ3EE2319):
Un determinado núcleo tiene 6 protones y 3 neutrones.
a.- Indicar el número atómico y el número másico.
b.- ¿De qué elemento se trata?
c.- Se sabe que el defecto de masa del núcleo corresponde al 1% de la suma de las masas de las partículas que constituyen el núcleo.
c.1.- Hallar la masa del núcleo en Unidades del Sistema Internacional.
c.2.- Hallar la energía de enlace del núcleo en U.S.I.
DATOS: c = 3·108 m/s; mp+= 1,6726·10-27 kg ; mn= 1,6749·10-27 kg.
IR AL VÍDEO CON LA SOLUCIÓN DEL EJERCICIO: https://youtu.be/sGlCAxOOwIE
CUESTIÓN 25: (FQ3EE2316):
Un determinado núcleo tiene 5 protones y 3 neutrones.
a.- Indicar el número atómico y el número másico.
b.- ¿De qué elemento se trata?
c.- Se sabe que el defecto de masa del núcleo corresponde al 1% de la suma de las masas de las partículas que constituyen el núcleo.
c.1.- Hallar la masa del núcleo en Unidades del Sistema Internacional.
c.2.- Hallar la energía de enlace del núcleo en U.S.I.
DATOS: c = 3·108 m/s; mp+= 1,6726·10-27 kg ; mn= 1,6749·10-27 kg.
ASPECTOS FORMALES ACTUALIZADOS LOMLOE PARA DOCENTES:
SE PRETENDE CON ESTA DINÁMICA EL DESARROLLO DE LAS COMPETENCIAS CLAVE:
-
- COMPETENCIA MATEMÁTICA Y EN CIENCIA, TECNOLOGÍA E INGENIERÍA (STEM), concretamente los DESCRIPTORES OPERATIVOS STEM1 , STEM2 , STEM3 ,STEM4
- COMPETENCIA EN CONCIENCIA Y EXPRESIÓN CULTURALES (CCEC), concretamente el DESCRIPTOR OPERATIVO CCEC2
- COMPETENCIA EN COMUNICACIÓN LINGÜÍSTICA (CLL), concretamente los DESCRIPTORES OPERATIVOS CCL1 , CCL2 , CCL3.
- COMPETENCIA DIGITAL (CD), concretamente el DESCRIPTOR OPERATIVO CD1 , CD2 , CD3 , CD4 y CD5
- COMPETENCIA EMPRENDEDORA (CE), concretamente el DESCRIPTOR OPERATIVO CE1 y CE3
- COMPETENCIA PERSONAL, SOCIAL Y DE APRENDER A APRENDER (CPSAA), concretamente el DESCRIPTOR OPERATIVO CPSAA1 , CPSAA3 , CPSAA4 , CPSAA5
- COMPETENCIA PLURILINGÜE, concretamente el DESCRIPTOR OPERATIVO CP1
-
- EN LAS CUESTIONES FINALES 22 Y 23 (EN AZUL)
-
CON RESPECTO A LAS COMPETENCIAS ESPECÍFICAS:
-
- COMPETENCIAS ESPECÍFICAS MATEMÁTICAS E.S.O. OBJETO DE LA ACTIVIDAD: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10
- COMPETENCIAS ESPECÍFICAS FÍSICA Y QUÍMICA E.S.O. OBJETO DE LA ACTIVIDAD: 1, 2, 3, 4, 5, 6
CRITERIOS DE EVALUACIÓN ASOCIADOS A LAS COMPETENCIAS ESPECÍFICAS DE FYQ PARA 3º E.S.O.:
FYQ 3ESO 1.1 , FYQ 3ESO 1.2 , FYQ 3ESO 2.2 , FYQ 3ESO 3.2 , FYQ 3ESO 6.1
CON RESPECTO A LOS SABERES BÁSICOS DE MATEMÁTICAS:
-
- I.- Sentido numérico:
- II.- Sentido de la medida:
- III.- Sentido Espacial:
- IV.- Sentido algebraico:
V.- Sentido estocástico:- VI.- Sentido socioafectivo:
CON RESPECTO A LOS SABERES BÁSICOS DE FÍSICA Y QUÍMICA:
-
- I.- Las destrezas científicas básicas.
- II.- La materia.
- III.- El cambio.
- IV.- La interacción.
- V.- La Energía.
ESTE MATERIAL TIENE RELACIÓN CON ASPECTOS DEL PERFIL DE SALIDA DEL ALUMNADO DE LOS INSTITUTOS DIOCESANOS DE CANARIAS

Comments are closed, but trackbacks and pingbacks are open.